 nções que, em conjunto, mantêm a vida do organismo como um todo.
nções que, em conjunto, mantêm a vida do organismo como um todo.O desafio surge da dificuldade de se aliar um mecanismo eficiente de transporte de substâncias, caracterizado pela movimentação de uma massa fluida aquosa, com a necessidade de que nele haja o trânsito de moléculas tão essenciais à vida quanto se mostram serem avessas à água, os lipídios (entre eles, o colesterol). Basta que vejamos a composição do Sistema Circulatório estruturado no transcorrer do histórico filogenético humano, para que possamos entender o aparente paradoxo encerrado por essa questão. Simplesmente, mais de 70% do tecido circulatório (sangue e linfa) é composto de água. E os lipídeos têm que entrar aí de alguma maneira.
Que truque possuíam, então, os seres ancestrais do Homem para que fossem selecionados de forma positiva pela natureza? Ora, como fizeram os seres vivos para findar o impasse: água como veículo de transporte X moléculas hidrofóbicas necessitando serem transportadas para todos os tecidos? Bom, a resposta vem com o advento de toda uma maquinaria especial para o transporte dessas moléculas, maquinaria essa que, óbvio, coexistiu e aperfeiçoou-se ao longo do trilhar da evolução e do histórico filogenético desses seres vivos, até que se chegasse ao modelo que hoje verificamos na espécie humana...
As Lipoproteínas.
O protagonista responsável pela transposição dessa aparente barreira é um conjunto de moléculas denominadas genericamente como
 Lipoproteínas. Elas compõem a química não só do sangue, mas, como poucos sabem, também da linfa. São representadas pelo HDL (High Density Lipoproteins), LDL (Low Density Lipoproteins), VLDL (Very Low Density Lipoproteins), IDL (intermediate Density Lipoproteins) e os Qilomícrons. Suas designações, com exceção dos Quilomícrons, são atribuídas em consonância com suas densidades, sendo que aquelas que possuem uma quantidade maior de lipídeos apresentarão uma menor densidade e mais danos podem causar à integridade dos vasos tanto sangüíneos quanto linfáticos dos indivíduos que evidenciam uma quantidade exacerbada de suas concentrações.
Lipoproteínas. Elas compõem a química não só do sangue, mas, como poucos sabem, também da linfa. São representadas pelo HDL (High Density Lipoproteins), LDL (Low Density Lipoproteins), VLDL (Very Low Density Lipoproteins), IDL (intermediate Density Lipoproteins) e os Qilomícrons. Suas designações, com exceção dos Quilomícrons, são atribuídas em consonância com suas densidades, sendo que aquelas que possuem uma quantidade maior de lipídeos apresentarão uma menor densidade e mais danos podem causar à integridade dos vasos tanto sangüíneos quanto linfáticos dos indivíduos que evidenciam uma quantidade exacerbada de suas concentrações.Por intermédio da microscopia eletrônica de transmissão e de varredura, além de outros métodos de estudo compositivo da matéria, verifica-se sua estruturação anatômica, que, aliás, assemelha-se àquela aplicada ao estudo das Membranas Plasmáticas, uma vez que ambos possuem uma natureza lipoproteica. Observe o esquema a seguir:

Como se vê, as lipoproteínas possuem uma capa periférica hidrossolúvel, de natureza fosfolipídica, com proteínas mergulhadas nessa superfície. A essas proteínas hidrossolúveis dá-se o nome de Apoproteínas ou Apolipoproteínas. Elas são peças-chave para a solubilização dos lipídios, o que possibilita seu efetivo transporte via plasma sangüíneo, bem como sua identificação e destinação correta para cada célula-alvo. Como ocorrem com as proteínas de Membrana Plasmática, elas podem ser classificadas como Intrínsecas (integrais) se transpassarem de um lado a outro da superfície fosfolipídica , ou Extrínsecas (periféricas) se apenas repousarem sobre essa superfície. No centro, há um núcleo ou “core”, onde residem os lipídios mais hidrofóbicos, dado a impossibilidade de interação com o meio aquoso nessa região.
Infere-se, pois, que quanto mais hidrofóbica ou apolar for a molécula, mais ao centro desse complexo ela estará e, por óbvia conclusão, quanto mais hidrofílica ou mesmo anfipática ela o for, encontrar-se-á mais na periferia dessa estrutura. Justifica-se assim o fato de os triglicerídeos e os ésteres de colesterol estarem mais ao centro. É necessário salientar que o colesterol livre compõe tanto a superfície da molécula, conferindo-lhe rigidez, como a parte intermediária entre o núcleo apolar e a superfície fosfolipídica, como se vê no esquema abaixo:

As diferenças primordiais entre cada lipoproteína estão no volume e no tipo majoritário de lipídios encontrado em cada uma delas, na natureza e na quantidade de suas apoproteínas. Veja a tabela a seguir:
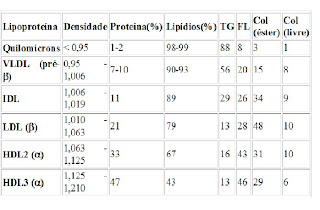 Sendo: TG = triglicerídeos; Col = Colesterol; FL = Fosfolipídeos
Sendo: TG = triglicerídeos; Col = Colesterol; FL = Fosfolipídeos
Como já foi dito, veja que a relação entre lipídeo e densidade mostra-se, de fato, inversamente proporcional. E, de posse desses dados, conclui-se que os Quilomícrons possuem o maior valor em massa de lipídeos, seguido por VLDL, IDL, LDL e, finalmente, o HDL. Os quilomícrons são também os mais volumosos, seguido do VLDL, o que diminuem ainda mais suas densidades e o que dá a eles a capacidade de turvar o plasma sangüíneo quando em excesso na circuitaria sangüínea e linfática.
A Dinâmica do Transporte do Colesterol (acompanhe o texto com o auxílio da figura abaixo)
 Após a ingestão de um alimento rico em lipídeos, os Quilomícrons produzidos pela mucosa intestinal recepcionam e englobam em seus núcleos (ou “core”) os triglicerídeos provenientes da dieta. Isso possibilita ao organismo a absorção dos lipídios via Circulação Linfática, uma vez que, por serem muito grandes, os Quilomícrons não ingressam nos capilares sangüíneos. Note que, por não seguirem a circulação porta-hepática, cujo primeiro destino é o fígado, os lipídios podem primeiro suprir as necessidades de armazenamento dos adipócitos.
Após a ingestão de um alimento rico em lipídeos, os Quilomícrons produzidos pela mucosa intestinal recepcionam e englobam em seus núcleos (ou “core”) os triglicerídeos provenientes da dieta. Isso possibilita ao organismo a absorção dos lipídios via Circulação Linfática, uma vez que, por serem muito grandes, os Quilomícrons não ingressam nos capilares sangüíneos. Note que, por não seguirem a circulação porta-hepática, cujo primeiro destino é o fígado, os lipídios podem primeiro suprir as necessidades de armazenamento dos adipócitos.
A circulação linfática ganha o sistema sangüífero via Ducto Torácico, vaso linfático que, normalmente, desemboca na altura da anastomose entre as veias Julgular Interna Esquerda e Axilar Esquerda, levando a linfa recém-chegada ao átrio direto do coração, juntamente com o sangue. Os Quilomícrons absorvidos na parede entérica entram, agora, em contato com o HDL sangüíneo, que os transfere duas apoproteínas essenciais para a liberação de seus triglicerídeos nos adipócitos, as Apo-C2 e Apo-E.
A Apo-C2 é o elemento discriminante dos Quilomícrons pelos adipócitos, porque aciona a enzima Lípase-lipoproteica ou Lipoproteína Lípase (LPL), a qual hidrolisa os tri-acil-gliceróis (triglicerídeos) em glicerol e ácidos graxos livres, subjacentemente ao tecido adiposo. Ele os capturam e os restaura em triglicerídeos para armazenagem. O mesmo ocorre com o VLDL (explicado mais adiante), também possuidor de Apo-C2.
Aos Quilomícrons resultantes da dinâmica de entrega de ácidos graxos para os adipócitos, isto é, Quilomícrons com baixo conteúdo de triglicerídeos, é dado o nome de Quilomícrons Remanescentes. Findada a sua utilidade, os Quilomícrons Remanescentes são absorvidos pelos hepatócitos, que metabolizam os conteúdos restantes de lipídios. Sua identificação pelo fígado ocorre pelo reconhecimento da Apo-B48 pelas células hepáticas, que o capturam assim que a identificação se estabelece. A Apo-E também tem esse papel.
O principal lipídio metabolizado pelos hepatócitos nessa fase é o colesterol proveniente da dieta, que tem como principais destinos: a excreção como ácido biliar ou como colesterol livre na bile, ajudando na emulsificação de lipídios ingeridos, durante o processo de digestão.
Prova-se, assim, que o colesterol proveniente da dieta pouquíssimo altera os padrões de colesterolemia sangüínea, dado que praticamente todo aquele absorvido permanece na composição dos Quilomícrons Remanescentes, sendo, após metabolização hepática, secretados na bile. Por isso, diz-se que os padrões de hipercolesterolemia não advêm do consumo direto de colesterol da dieta, mas sim do processamento endógeno de outros lipídios consumidos e, no fígado, transformados em colesterol e secretados para a corrente sangüínea.
No fígado, ocorre a produção de colesterol e de triglicerídeos todas as vezes que há um aumento considerável da concentração de Acetil-CoA, por isso, tanto o consumo exagerado de lipídios como o de açúcares é maléfico para quem tem grande tendência à hipercolesterolemia, já que ambos originam Acetil-CoA em transformações metabólicas. Os lipídios endógenos produzidos (colesterol e tri-acil-glicerol) são lançados à corrente sangüínea pela lipoproteína VLDL, possuidora da Apo-B100, além de outras.
Semelhantemente ao que ocorre com os Quilomícrons, o VLDL recebe do HDL as Apo-C2 e Apo-E. Assim, há o mesmo reconhecimento com os adipócitos - já citado – resultando na ativação da Lipoproteína Lípase, com sua mais que importante ação de trâmite lipídico entre lipoproteína e tecido adiposo. Ocorre um novo armazenamento de tri-acil-glicerol no adipócito, permanecendo o VLDL com o colesterol.
Sem os triglicerídeos compondo o VLDL, resultando, então, em uma diminuição de lipídios nessa estrutura, ela perde tamanho e fica mais densa, conforme explicado anteriormente. Nisso se constituem os IDL, também chamados de VLDL Remanescentes. A eles é dado o destino de: (I) ou o de devolverem ao HDL as Apo-C2 e Apo-E, mesmo porque não há mais triglicerídeos no seu interior a entregar, tornando-se desnecessário a permanência da Apo-C2 em sua estrutura (dessa forma, o HDL poderá doar novamente para outro VLDL essas apoproteínas, reiniciando o ciclo); (II) ou o de serem recolhidos pelo fígado, uma vez que possuem Apo-E, que é reconhecida pelo hepatócito como sinal de “alvo de captura” para metabolizações diversas.
Trabalhando com a hipótese numero “I”, após a devolução das apoproteínas, o IDL recebe do HDL ésteres de colesterol, aumentando seu conteúdo de lipídio e, por isso, diminuindo sua densidade. Surge o LDL. Como foi derivado do IDL, o LDL possui uma apoproteína denominada Apo-B100 e muito colesterol para ser repassado aos tecidos, preferencialmente àqueles que produzem hormônios sexuais (Gônadas e Supra-Renais), que têm como precursores o colesterol. Eis aí uma de suas maiores importâncias, além de outras citadas adiante.
Como as células componentes das gônadas e das supra-renais já têm uma capacidade elevada de produção desse composto, sua concentração no interior hialoplasmático é regulado pela forma com que o colesterol presente no LDL é absorvido. A existência de um receptor para a Apo-B100 no glicocálix dessas células é fundamental nesse controle, pois, no momento de encaixe Apo-B100/receptor, há a internalização do complexo receptor/lipoproteína. Se essas células não estiverem precisando de suprimento de colesterol, ela retira o receptor da membrana, havendo acúmulo de LDL no plasma sangüíneo (embora o fígado também reconheça a Apo-B100) à aumenta-se a deposição de LDL na parede dos vasos, podendo gerar doenças cardiovasculares graves.
Como se vê, o HDL é importantíssimo para a manutenção da homeostase dessa dinâmica de trânsito lipídico. Além do mais, estudos mostram que valores elevados dessa lipoproteína representam êxito na retirada de LDL fixados nas paredes de vasos da circuitaria sangüífera, pois captura o colesterol livre presente em sua composição, podendo esterificá-lo por meio de uma enzima denominada Lecitina Colesterol-Acil-Transferase (LCAT - lê-se licat) e incorporar esses ésteres. Depois, como mostrado acima, ele transfere estes ésteres para VLDL circulantes (não depositados em paredes vasculares), transformando-o em LDL, como supra-citado. Isso favorece o consumo desse excesso pelo Fígado e pelas células das Supra-Renais e das Gônadas, no momento em que houver necessidade. O HDL ainda pode ser captado pelo Fígado e ter seu colesterol excretado na forma de ácidos biliares e colesterol livre na bile, a exemplo do que ocorre com o colesterol presente em Quilomícrons. É por tudo isso que o HDL é vulgarmente e incorretamente chamado de “colesterol” bom! Mas, de fato, corresponde em um excelente agente do feedback lipídico sangüíneo. E, por último, como ainda não foi dito, o HDL é produzido unicamente pelo fígado e possui sua concentração consideravelmente elevada em indivíduos com hábitos saudáveis e que ingerem regularmente os chamados lipídios insaturados, presentes, por exemplo, no azeite extra virgem.
Quadro-Resumo

Bibliografia:
http://www.geocities.com/CapeCanaveral/Launchpad/9071/Lipoprot.html
http://www.geocities.com/bioquimicaplicada/resumoslipoproteinas.htm
